Вы вошли как Гость
Текущая дата: Суббота, 2024-04-20, 3:36 PM
|
Проводка и заливка
|
|
| nastja | Дата: Вторник, 2016-08-30, 9:31 PM | Сообщение # 496 |
|
Подполковник
Группа: Патоморфологи
Сообщений: 64
Статус: Offline
| не прикрепилось фото Добавлено (2016-08-30, 9:30 PM)
---------------------------------------------
прошу прощения, не прикреплялось фото Добавлено (2016-08-30, 9:31 PM)
---------------------------------------------
Фото со стеклами так и не прикрепляется.
|
| |
| |
| Maxim | Дата: Четверг, 2016-09-01, 11:17 PM | Сообщение # 497 |
|
Профессионал
Группа: Модераторы
Сообщений: 555
Статус: Offline
| Настя, я посмотрел состав крема Veet: http://kremys.ru/wiki/krem-veet-dlya-depilyatsii.html
На мой взгляд, подходящий состав. Может быть, лучше было бы смочить блок кремом во время резки на 5-10 минут, раз не получилось перед проводкой?
Конечно, ксилол тоже дает жесткость, но других вариантов проводки у Вас нет.
Сам коготь состоит из кератина и там ждать что-то кроме кератиновых масс врядли получится. Конечно, в глубине есть и сосуды...Добавлено (2016-09-01, 11:17 PM)
---------------------------------------------
И еще: не используйте для таких крупных объектов биопсийные губки - через них реагенты хуже проходят. И для эндоскопий лучше использовать либо фильтровалку, либо биопсийные кассеты с очень мелкими отверстиями. Но не губки или поролон.
|
| |
| |
| nastja | Дата: Пятница, 2016-09-02, 8:37 PM | Сообщение # 498 |
|
Подполковник
Группа: Патоморфологи
Сообщений: 64
Статус: Offline
| Maxim, я, видимо, сумбурно написала - перед проводкой после декальцинирования дней 5 коготь лежал в креме. Только после этого получилось сделать вырезку. Использовали ли лаборанты крем во время нарезки я, к сожалению, не знаю, должны были. Чтоб не быть голословной, очень постараюсь сделать фото, пока просто нет камеры.
|
| |
| |
| Oksana) | Дата: Понедельник, 2016-09-19, 10:55 AM | Сообщение # 499 |
|
Майор
Группа: Пользователи
Сообщений: 7
Статус: Offline
| Здравствуйте, Maxim и все участники форума! Работаю на мышах с нейродегенерацией. Планирую попробовать окраску из «Микроскопической
техники» п/р Д.С. Саркисова(с.370) Используются амидочерный 10Б и кислый
фуксин. Рекомендовано фиксировать ткань в жидкости Карнуа. Отсюда вопрос:
фиксация в Карнуа принципиальна? Материал, зафиксированный в формалине уже не
подойдет? Обычная проводка ИП-масло после этой фиксации возможна? В описании другой методики встретила такие
рекомендации – после прижизненной транскардиальной перфузии 4% формалином,
ткань фиксировали в Карнуа, а затем проводка с этанолом-хлороформом. Удивило
сочетание формалина и Карнуа.
,
Сообщение отредактировал Oksana) - Понедельник, 2016-09-19, 12:33 PM |
| |
| |
| Maxim | Дата: Вторник, 2016-09-20, 8:54 AM | Сообщение # 500 |
|
Профессионал
Группа: Модераторы
Сообщений: 555
Статус: Offline
| Oksana, что касается фиксации - здесь сложный момент. Поскольку Карнуа дает отличную ядерную деталировку, но сильно сжимает цитоплазму и всякие цитоплазматические детали, то картинка после формалина и после Карнуа будет различной, а после Карнуа и последующего формалина третьей. Какая больше вам подойдет, как раз и есть смысл выяснить в ходе предварительной настройки метода, которым вы будете впоследствии работать. У Саркисова приведен метод окраски, который сочетает в себе несколько методов и цели у авторов отличаются от ваших. Что касается способ введения фиксатора - перфузия, безусловно предпочтительна.
Метод проводки можно использовать любой. Помните, что после Карнуа не требуется промывка в воде, объекты сразу можно переносить в спирты (изопропанол). Проводка с маслом вполне применима - здесь противопоказаний нет.
Если интересуют определенные белки, лучше использовать ИГХ. В прежние времена далеко не у всех исследователей была возможность проводить такие исследования.
Конечно, интересно будет увидеть здесь результаты (если не жалко).
|
| |
| |
| Oksana) | Дата: Вторник, 2016-09-20, 9:10 AM | Сообщение # 501 |
|
Майор
Группа: Пользователи
Сообщений: 7
Статус: Offline
| Maxim, спасибо большое! Значит буду пробовать и с одним и с другим фиксатором. Конечно же покажу, если сумею добиться внятного результата.
|
| |
| |
| первопроходец | Дата: Среда, 2017-01-04, 11:06 AM | Сообщение # 502 |
 Лейтенант
Группа: Проверенные
Сообщений: 51
Статус: Offline
| Уважаемые коллеги, может кто знаком со стейнером Leica ST5020? Нам подогнали в новый корпус это чудо, есть возможность проводки сразу нескольких кассет, но мы не можем сообразить, как продумать программу, что бы кассеты не пересекались . Буду очень благодарна за помощь 
|
| |
| |
| Maxim | Дата: Среда, 2017-01-04, 11:30 AM | Сообщение # 503 |
|
Профессионал
Группа: Модераторы
Сообщений: 555
Статус: Offline
| Кроме установки оборудования вас еще должны будут обучить пользованию этим прибором. Инженера можно будет пытать, пока он будет у вас (потом обычно вытащить его к себе куда сложнее, особенно если сервис расположен в другом городе, да и денег это стоит не малых).
По опыту работы со стейнерами скажу, что при загрузке протокола предусмотрена настройка в программе по минимальному времени нахождения корзинки со стеклами по времени задержки в станции - это нужно прописать обязательно.
Например, в протоколе ГЭ на любой станции можно делать неограниченную задержку, кроме гематоксилина (если его формула регрессивная), дифференцирующего раствора и эозина. Все остальное не критично в плане увеличения времени пребывания в реагентах. Стейнер сам все раскинет оптимальным образом - на то у него есть программные штучки, котооые позволят выполнить весь протокол оптимально.
Даже если вы не выставите максимальное время задержки, и тогда он просчитает сам как оптимально закончить работу. Но в этом случае просто удлиняется время исполнения следующих запусков. При пересечении исполнения разных программ также время задержки оптимизирует работу.
До прихода инженера вам нужно ручками четко отработать оптимальное время окраски в каждом протоколе, который будете забивать в стейнер с учетом толщины срезов (важно в одной партии стекол компоновать одинаковую толщину срезов, а протоколов иметь несколько - например ГЭ для 3 мкм, ГЭ для 5 мкм, если режут по-разному). Тогда и результаты будут оптимальными.
Ну и график смены реагентов тоже нужно продумать заранее, а инженеру только дать готовые вещи. Ведь у него время работы ограничено и пользу нужно поиметь максимально. Нужно четко понять ход загрузки программ и возможности коррекций. Да, все продублировано в руководстве пользователя, но практика показывает, что самостоятельно в этом могут разбираться только очень продвинутые люди.
|
| |
| |
| первопроходец | Дата: Среда, 2017-01-04, 12:38 PM | Сообщение # 504 |
 Лейтенант
Группа: Проверенные
Сообщений: 51
Статус: Offline
| Спасибо огромное! Будем сами разбираться, инженер сказал дать ему программу, а он ее введет.
|
| |
| |
| Maxim | Дата: Среда, 2017-01-04, 3:14 PM | Сообщение # 505 |
|
Профессионал
Группа: Модераторы
Сообщений: 555
Статус: Offline
| Это уникальный момент вытрясти из инженера максимум пользы. Для этого он там и будет. Будьте рядом и пусть объясняет каждое действие. В идеале рядом нужно раскрыть руководство пользователя и пооперационно смотреть, как заполнять строки программы и все остальные моменты. Также нужно потом распечатать этот файл и еще раз пересмотреть на предмет ошибок пошагово. Он ведь потом скажет, что это вы ему дали файл, а он ничего не придумывал. Для этого протокол должен быть идеально оттестирован руками и желательно в этот момент не делать перехода на другие реагенты а уточнить возможность исправления времени нахождения в том или ином реагенте.
Автомат - простой исполнитель вашей воли, поэтому вы должны четко понимать что вы от него хотите.
Ляйка - вполне надежный стейнер. И использовать его нужно на полную катушку. Особенно детально присмотритесь к работе аппарата для заключения, если вам его тоже ставят - очень капризная штучка (независимо от производителя).
Также обязательно разберите с инженером регламентные работы и уход за аппаратом. Если его вовремя не промыть-прочистить - вырастут грибы. Видел такое много раз.
Успешного освоения новинки.
|
| |
| |
| dzubenko-lisa | Дата: Понедельник, 2017-01-16, 12:12 PM | Сообщение # 506 |
|
Рядовой
Группа: Пользователи
Сообщений: 12
Статус: Offline
| Здравствуйте всем, подскажите пожалуйста у кого как поставлена работа (от приёма материала до подачи врачу, касательно лаборантов и регистраторов) в связи с приказом 179н от марта 2016? А то у нас какой то хаос в связи с этим... Интересно регистрация материала как проходит сразу при приёме или нет... Поделитесь пожалуйста по пунктам
|
| |
| |
| pisikot2706 | Дата: Понедельник, 2017-02-13, 3:12 PM | Сообщение # 507 |
|
Рядовой
Группа: Пользователи
Сообщений: 11
Статус: Offline
| Добрый день, уважаемые форумчане! Являюсь новичком и пытаюсь освоить проводку с изопропанолом. Работаю с мышами, крысами, кроликами. Получается ерунда полная. Соблюдаю все правила по толщине, времени и тд. Лезвия одноразовые, стекла с полилизином. Режется хорошо, лента получается, а срезы все в трещинах, края не расправлены, заворачиваются (на воде все нормально), клетки деформированы. Кусок в блоке через пару дней проваливается в середине, и по краям кусок матовый, в центре глянцевый. Единственное осталось грешить на формалин, старые запасы; жду, когда придёт новый. В связи с этим, хочу спросить, какие признаки некачественной фиксации в формалине?
|
| |
| |
| Maxim | Дата: Понедельник, 2017-02-13, 9:56 PM | Сообщение # 508 |
|
Профессионал
Группа: Модераторы
Сообщений: 555
Статус: Offline
| Уважаемый pisikot2706!
Описанная ситуация иллюстрирует проблему с фиксацией. Формалин используете забуференный или концентрат? Если концентрат - обязательно встряхивайте осевшую на дно муть - это и есть сам формальдегид. Надосадочная прозрачная жидкость - просто вода и не оказывает фисирующего действия. Мутную взвесь из концентрата нужно обязательно растворять горячей водой и желательно забуферивать - тогда будет толк. Муть может не раствоириться сразу. Тогда поставьте канистру с приготовленным раствором на пару-тройку дней в термостат 60оС, обязательно хорошо закройте крышку! Периодически - раз в 1-2 часа перебелтывайте раствор. Через 2-3 дня, если повезет, он превраться в хороший фиксатор. Перед фиксацией проверьте рН хотя бы индикаторными полосками.
Кусочек хорошо зафиксированный в формалине должен быть плотноватый, равномерно-серый, где кровь - коричневый.
Ткани грызунов обычно содержат меньше воды, чем ткани человека, поэтому им слишком сильное обезвоживание не нужно. Обязательно нужно увеличить время пропитывания парафином как минимум в 2-3 раза. Хорошо фиксированные и правильно проведенные ткани не будут никак изменяться в залитом и срезанном блоке на протяжении очень долгого времени.
|
| |
| |
| pisikot2706 | Дата: Понедельник, 2017-02-13, 10:27 PM | Сообщение # 509 |
|
Рядовой
Группа: Пользователи
Сообщений: 11
Статус: Offline
| Maxim, спасибо за ответ. Формалин 40%, готовлю 10%, забуфериваю. Из канистры, где осадок, не использую формалин. Беру из другой., где он прозрачный. Но ему как минимум лет 6. В парафинах держу по часу, всего 4 часа. И пробовала фиксировать в термостате в 37%, 2 суток. После кусочки фиксированные разрезала, чтобы убедиться, что профиксированы. Результат такой же. Моя старшая коллега, которая много лет делает гистологию и проводит в этаноле, тоже срезы в трещинах, но смотреть можно. У меня же ужас. Какой рн должен быть у формалина?
|
| |
| |
| Maxim | Дата: Понедельник, 2017-02-13, 10:56 PM | Сообщение # 510 |
|
Профессионал
Группа: Модераторы
Сообщений: 555
Статус: Offline
| Вот эта муть - и есть то, что нужно, а вы от него избавляетесь. Смелее взбивайте эту муть и ее выливайте в нужном количестве, как я написал в предыдущем сообщении. Изначально в формальдегиде нет 40%. С лучшем случае 37. В итоге муть в термостате растворится обязательно и получится прозрачный раствор. рН должно быть около 7. Даже если вы разведетеего на водопроводной воде, и рН будет приближаться к 6.5 - это уже хорошо, раз нет фосфатов и сделать буфер нечем.
Спирты частично участвуют в фиксации и коагулируют все то, что не связал формалин - получается смесь спиртовой и формалиновой фиксации, которая дает вполнесносную, а иногда и лучшую картинку, но за другие тесты, особенно ИГХ ручаться невозможно.
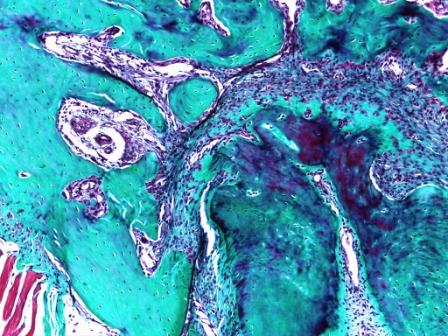
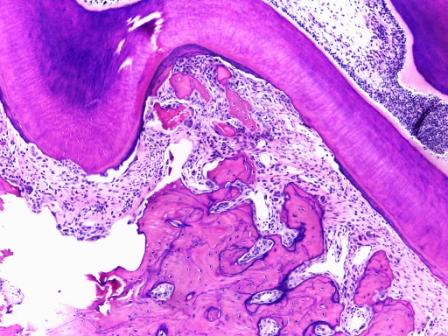
Я тоже работаю с крысами и даже их челюстями. Все получается нормально (но у меня хороший формалин и проводка, правда на минеральном масле). Попробую приложить фотки.
Гематоксилин-эозин, челюсть крысы
Массон-Голднер, челюсть крысы.
|
| |
| |
|

|